Por favor, si quieres compartir el contenido de esta entrada,
nombra siempre la fuente. No te aproveches del trabajo de otrxs,
citar y enlazar esta bien, pero copiar es una
falta de respeto al tiempo y esfuerzo de los demás.
Como comentaba en la primera parte de esta entrada que puedes ver aquí, el paradigma de la obstetricia está en un momento de cambio. Durante los últimos cien años la medicina clínica apenas ha cambiado, sino que han sido los grandes avances en farmacología y en tecnología diagnóstica los protagonistas de la ciencia del siglo XX y parece que van a ser también del siglo XXI. La inmensa mayoría de los estudios publicados hoy en día son ensayos clínicos de nuevos fármacos o estudios sobre la efectividad de programas de screening y diagnóstico precoz o una nueva técnica de diagnóstico por imagen.
Como ya dije con el tema de los antibióticos y su influencia con la microbiota, no se trata aquí de negar los efectos beneficiosos de estos avances, sino de sentarse a pensar de manera crítica, abrir el debate, desmontar ciertos mitos y al final, poner información sobre la mesa para que cada una tome las decisiones que crea convenientes.
Desde el paradigma actual de atención al proceso reproductivo, la mejora de la salud materno-fetal se ha asociado enormemente al uso de programas de diagnóstico en el embarazo. Desde los iniciales rayos X, al uso de ecografía, test genéticos y hormonales, el cuidado del embarazo ha ido cambiando progresivamente en los últimos cien años, siendo hoy en día un cuidado prenatal basado mayoritariamente en el paradigma médico.
Antes de continuar, me gustaría compartir aquí un breve resumen muy claramente expuesto y defendido por Sarah Wickham sobre las diferencias entre el enfoque médico en obstetricia y el enfoque de las comadronas.
Modelo médico
|
Modelo comadronas
|
Intervención
|
Intercesión
(promoción)
|
Suele
implicar procedimientos, a veces invasivos
|
No
suele implicar procedimientos
|
Basado
en la tecnología y en la farmacología
|
Basado
en el cambio de estilos de vida. Puede implicar el uso de sustancias
naturales o combinarse con terapias complementarias
|
El
objetivo es la curación o la solución de un problema percibido en el cuerpo
|
El
objetivo es trabajar con el cuerpo para optimizar el potencial fisiológico
|
Tratamientos
rutinarios y protocolizados
|
Cuidado
individualizado a la mujer y sus necesidades/elecciones
|
Dirigido
por profesionales
|
Dirigido
por la propia mujer
|
Orientado
a la detección de patología, puede entorpecer la fisiología
|
Orientado
a potenciar la fisiología
|
¿Por qué es importante hacer esa diferenciación? Porque el cuidado prenatal cambia radicalmente.
Al hablar de cuidado prenatal desde el paradigma de las comadronas, entendemos este proceso como un momento para potenciar la salud, para aprender y adquirir hábitos saludables, para empoderarse en el autocuidado, y con ello, transmitir Salud a la siguiente generación. Dentro del paradigma de las comadronas, el cuidado prenatal tiene el objetivo de potenciar la Vida y trabajar desde la fisiología, optimizando el funcionamiento normal del cuerpo de la mujer, para la cual el embarazo es una función FISIOLÓGICA y normal en su vida reproductiva. Esto implica, que, tras millones de años de evolución, es un proceso francamente bien diseñado, donde solo los cambios que son favorables para la perpetuación de la especie se han mantenido.
La patología desde el modelo de las comadronas aparece cuando hay factores de diversas características que dificultan el funcionamiento fisiológico. Si la mujer trabaja para eliminar esos factores precozmente y sustituirlos por factores potenciadores de salud, se protege la fisiología y se reduce el riesgo de complicaciones.
Sin embargo, el modelo médico obstétrico de cuidado prenatal está basado en la detección de PATOLOGÍA para tratar un problema. Se decir, tiene el objetivo de curar la enfermedad al detectarla precozmente. Pero para poder detectarla en los pocos casos en los que ocurre, necesita aplicar procedimientos rutinarios de manera generalizada a toda la población. Y esos procedimientos suelen implicar intervenciones basadas en tecnología, ya sea una analítica sanguínea, una ecografía, un monitor o una amniocentesis. El cuidado prenatal se convierte en un gran examen donde la mujer, en cada consulta, debe pasar unos test con un experto, que es el que controla el embarazo.
De esta manera, la atención actual al embarazo se basa principalmente en programas de screening, pruebas prediagnósticas, que han dejado de ser una herramienta para mejorar la salud de las madres para convertirse en un sistema de clasificación de las embarazadas según niveles de riesgo: las que tienen riesgo de enfermedades infecciosas, las que tienen riesgo de anemia, las que tienen riesgo de isoinmunización, las que tienen riesgo de anomalías cromosómicas, las que tienen riesgo de embarazo prolongado, las que tienen riesgo de bebés grandes o bebés pequeños, las que tienen riesgo de diabetes, las que tienen riesgo de tensión alta, etc etc etc...
El cuidado prenatal ha pasado de ser una herramienta de empoderamiento en salud a ser un proceso de ticking boxes, de ir pasando test como el que pasa pantallas de un programa de ordenador.
Actualmente, de manera más o menos generalizada en Europa, existen diferentes programas de screening más o menos formales dentro de la salud materno fetal: malformaciones fetales, enfermedades hematológicas, diabetes gestacional, o enfermedades infecciosas, por poner un ejemplo.
Pero todos estos programas, ¿han conseguido mejorar la salud materno fetal? Como siempre insisto, cualquier intervención tiene beneficios, pero también riesgos asociados. ¿superan los beneficios a los riesgos? ¿conocemos los riesgos?
Por ejemplo, el programa de malformaciones fetales, ¿ha conseguido mejorar la salud fetal? Realmente no, lo único que se ha conseguido es reducir el número de bebés nacidos con esas malformaciones porque esos embarazos se interrumpen precozmente, pero la salud fetal en ese caso no se ha mejorado. Se diagnostica, pero no se puede tratar o prevenir eficazmente (por si alguien lo plantea, el uso de ácido fólico rutinario para la prevención de defectos del tubo neural (por poner un ejemplo de medida de prevención) sigue estando en debate y hay distintas controversias al respecto)
Y sin embargo, ¿existen riesgos asociados a estos programas? Simplemente pensemos en factores generalmente minimizados desde el sistema de salud como la ansiedad materna o el aumento de la medicalización del embarazo, (con el consiguiente aumento del riesgo de inducción, de cesárea, de infección, etc etc.) Con esto no digo que todos los programas de screening sean inútiles, sino que no son inocuos.
Hablar de beneficios y riesgos de cada uno de los programas de screening y test que se hacen en el embarazo daría no ya para varias entradas, sino para escribir tranquilamente un libro. No es mi objetivo aquí, sino más bien abrir el debate y la reflexión: debemos plantearnos el balance beneficio/riesgo, tanto a nivel individual, como poblacional. Ninguna intervención en el embarazo debería ser rutinaria, sino individualizada y ofertada para que la mujer escoja si desea participar en el programa o no.
Y dentro de todo ese paradigma entorno al cuidado prenatal, existen dos pruebas de screening que se han convertido en el gold standard de la obstetricia moderna: la ecografía y la monitorización fetal electrónica. Convertirse en el gold standard significa que parece que solo por usarlas, ya son curativas y al tener esa percepción de ellas, cuando aparecen resultados adversos, se crucifica a quién decidió no usar monitorización continua o no hizo una ecografía extra, como si por haberlas hecho nos pudieramos asegurar que ese resultado adverso no iba a haber ocurrido.
Es decir, tanto la ecografía como la monitorización, se convierten en incuestionables, y peor aún, en la base de una medicina del "por sí acaso", de una medicina defensiva que más que seguir criterios clínicos y científicos, sigue criterios legales defensivos. (problema también del sistema cultural, que llevamos a juicio al que no puso un monitor en un embarazo de bajo riesgo, pero no al que acabó haciendo una cesárea por poner un monitor sin indicación).
Actualmente, de manera más o menos generalizada en Europa, existen diferentes programas de screening más o menos formales dentro de la salud materno fetal: malformaciones fetales, enfermedades hematológicas, diabetes gestacional, o enfermedades infecciosas, por poner un ejemplo.
Pero todos estos programas, ¿han conseguido mejorar la salud materno fetal? Como siempre insisto, cualquier intervención tiene beneficios, pero también riesgos asociados. ¿superan los beneficios a los riesgos? ¿conocemos los riesgos?
Por ejemplo, el programa de malformaciones fetales, ¿ha conseguido mejorar la salud fetal? Realmente no, lo único que se ha conseguido es reducir el número de bebés nacidos con esas malformaciones porque esos embarazos se interrumpen precozmente, pero la salud fetal en ese caso no se ha mejorado. Se diagnostica, pero no se puede tratar o prevenir eficazmente (por si alguien lo plantea, el uso de ácido fólico rutinario para la prevención de defectos del tubo neural (por poner un ejemplo de medida de prevención) sigue estando en debate y hay distintas controversias al respecto)
Y sin embargo, ¿existen riesgos asociados a estos programas? Simplemente pensemos en factores generalmente minimizados desde el sistema de salud como la ansiedad materna o el aumento de la medicalización del embarazo, (con el consiguiente aumento del riesgo de inducción, de cesárea, de infección, etc etc.) Con esto no digo que todos los programas de screening sean inútiles, sino que no son inocuos.
Hablar de beneficios y riesgos de cada uno de los programas de screening y test que se hacen en el embarazo daría no ya para varias entradas, sino para escribir tranquilamente un libro. No es mi objetivo aquí, sino más bien abrir el debate y la reflexión: debemos plantearnos el balance beneficio/riesgo, tanto a nivel individual, como poblacional. Ninguna intervención en el embarazo debería ser rutinaria, sino individualizada y ofertada para que la mujer escoja si desea participar en el programa o no.
Y dentro de todo ese paradigma entorno al cuidado prenatal, existen dos pruebas de screening que se han convertido en el gold standard de la obstetricia moderna: la ecografía y la monitorización fetal electrónica. Convertirse en el gold standard significa que parece que solo por usarlas, ya son curativas y al tener esa percepción de ellas, cuando aparecen resultados adversos, se crucifica a quién decidió no usar monitorización continua o no hizo una ecografía extra, como si por haberlas hecho nos pudieramos asegurar que ese resultado adverso no iba a haber ocurrido.
Es decir, tanto la ecografía como la monitorización, se convierten en incuestionables, y peor aún, en la base de una medicina del "por sí acaso", de una medicina defensiva que más que seguir criterios clínicos y científicos, sigue criterios legales defensivos. (problema también del sistema cultural, que llevamos a juicio al que no puso un monitor en un embarazo de bajo riesgo, pero no al que acabó haciendo una cesárea por poner un monitor sin indicación).
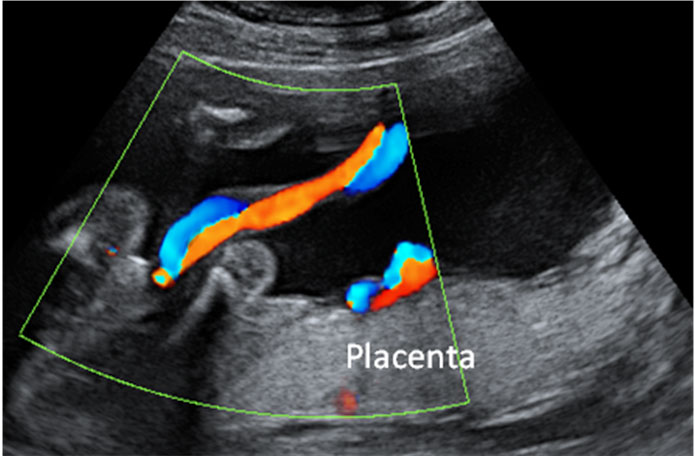
Ecografía
Bibliografía
Desde que se empezaron a usar los primeros rayos X y se empezaron a obtener imágenes del útero materno, la tentación de tener una ventana cada vez más nítida a la vida intrauterina no ha parado de crecer. No existe otra función fisiológica del cuerpo humano que se someta a tanta técnica de diagnóstico por imagen de manera rutinaria que el embarazo. Y lo que una vez se diseñó como herramienta para mejorar la salud materna, hoy incluso se ha convertido en negocio rentable para que padres y madres impacientes, que en esta sociedad del todo y del ahora, no pueden esperar 9 meses para ver la cara a su bebé.
Al contrario de lo que ocurre en otras especialidades, en obstetricia muchas veces se empieza a aplicar una intervención sin que los beneficios/riesgos se hayan estudiado claramente, y luego nos cuesta años y años de investigación y reeducacion de profesionales y usuarias conseguir que se use con cautela y tan sólo cuando los beneficios superan a los riesgos.
Y lo cierto es que con la ecografía, no tenemos suficientes estudios para afirmar que se trate de una técnica segura. Existe poca investigación al respecto, casi toda en el ámbito de la experimentación animal y con muestras pequeñas, pero aun así, que no tengamos conclusiones fuertes acerca de los riesgos no implica que estos no existan.
Desde mi punto de vista y tras mi experiencia profesional, algo a tener en cuenta es la reacción de los bebés cuando se les expone a la energía del ecografo o del sonicaid: casi todos se mueven en dirección contraria, como si intentaran evitarlo. Algo deben sentir entonces.
Lo cierto es que hoy en día estamos debatiendo sobre los posibles efectos de la ecografía en los tejidos fetales, especialmente en el cerebro en formación. Se considera que hay tres modos en que la ecografía puede afectar al tejido: por calor, por cavitación o por vibración acústica, siendo la hipótesis más popular actualmente la basada en el calor.
Vaya por delante que, aunque como voy a detallar a continuación, diferentes estudios en población animal y humanos han demostrado que el aumento de la temperatura puede provocar desarrollos anómalos y defectos del nacimiento, hasta el momento los estudios en humanos no han demostrado ninguna relación causal entre el uso de las ecografías diagnósticas y efectos adversos en el desarrollo del bebé. (1)
Entre los riesgos que podrían estar asociados a la ecografía se habla de hemolísis en los tejidos cerebrales(2), reducción de la tasa de división celular y aumento de la tasa de muerte celular programada en el intestino delgado (3), (ambos estudios en ratones), o retraso en lenguaje en niñxs expuestos a más ecografías de lo habitual (4) (muestra pequeña y con una metodología cuestionable).
La ecografía con fines diagnósticos se utiliza principalmente para detectar malformaciones congénitas y/o problemas de crecimiento. Como decía más arriba, el paradigma médico presupone enfermedad hasta que se pruebe lo contrario. De esta manera, hemos pasado de considerar que el feto estaba sano hasta que hubiese evidencia de lo contrario, a tener que probar la salud o normalidad del bebé.
Pero, ¿son todas las malformaciones detectables por ecografía? Diferentes estudios hablan de que incluso en centros de tercer nivel con profesionales bien entrenados, hasta un 40% de las malformaciones pueden pasar desapercibidas. Y es que algunas malformaciones son muy difíciles o casi imposibles de detectar por ecografía, como algunos problemas cardíacos, donde la detección puede variar entre el 21 y el 39%. Los problemas musculoesqueléticos se detectan aún con menos frecuencia, en un 18% de los casos. (5). Otras patologías no pueden ser detectadas prenatalmente, como el autismo, la parálisis cerebral, la sordera, etc.
Pero no solo se trata de los casos que no se detectan, sino que también existe el riesgo de sobrediagnostico. En un estudio en el Reino Unido, un 1'4% de los hayazgos por ecografía no pudieron ser confirmados en el estudio postmortem, en un 0,5% la malformación resultó ser menos severa que lo que se predijo por ecografía y en el caso de las malformaciones severas, la ecografía sobrediagnosticó o infradiagnosticó la condición en un 2'4%. (6) El riesgo de falsos positivos es muy bajo, pero dado que se trata de situaciones que pueden originar una interrupción del embarazo, es importante considerarlo.
Y no solo hay que considerar si la ecografía es fiable, sino también si el uso rutinario de ecografías ha conseguido mejorar la salud perinatal. Lo cierto es que las técnicas de diagnóstico prenatal realmente no incrementan la salud de los bebés que llegan a nacer, sino que permite el diagnóstico temprano para tener la opción de interrumpir la gestación de una bebé con una patología que pudiera acarrear una morbimortalidad. Es decir, hacer una ecografía para descartar la espina bífida no ha mejorado la salud de los bebés con espina bífida ni ha reducido la proporción de bebés que la padecen intraútero, solo ha reducido el número de bebés que llegan a nacer con esa patología.
En esta misma línea, ha ido una de las conclusiones de Ibone Olza sobre el último congreso de la SEGO en España que publicaba esta semana en su blog:
En esta misma línea, ha ido una de las conclusiones de Ibone Olza sobre el último congreso de la SEGO en España que publicaba esta semana en su blog:
¿Hacia dónde va la medicina fetal? La impresión que he sacado en este congreso es que los obstetras están volcados en la detección temprana de cualquier malformación o problema fetal, pero de momento casi lo único que pueden ofrecer en esos casos es la interrupción del embarazo.
En diferentes estudios, las tasas de resultados adversos (muerte fetal y neonatal y morbilidad neonatal) son similares en bebés sometidos a ecografía de rutina y bebés que no han tenido esas ecografías. El uso rutinario de ecografía durante el embarazo no ha probado ser eficaz en términos de resultados perinatales. (7)
En la actualidad, en el ámbito europeo está en debate la pertinencia de una ecografía en el tercer trimestre. Mientras que en España (especialmente en el ámbito privado) estamos aumentando cada vez más el uso de ecografía, muchos países se están cuestionando o están eliminando la ecografía rutinaria del tercer trimestre. Quienes defienden su permanencia se basan principalmente en la prevención de casos de crecimiento restringido, que podían aumentar los casos de muerte fetal tardía. Sin embargo, ¿es útil la ecografía para esto?
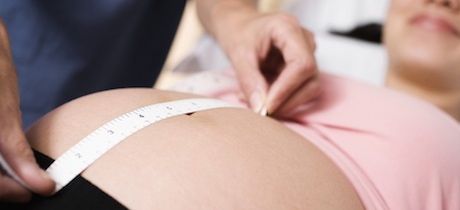 En la revisión que publicó el recientemente fallecido Masden Wagner en Midwifery Today allá por 1999, (7) recogía diferentes conclusiones al respecto: la palpación abdominal por una comadrona o un médico experimentado son tan precisas en la detección de casos de crecimiento restringido como hacer una ecografía. Esto mismo concluyó un estudio en Suecia que comparaba la medición repetida del útero por la comadrona frente a las mediciones de la cabeza fetal por ecografía, siendo en este caso las comadronas más eficaces que la ecografía. De hecho, la tasa de falsos positivos para los casos de crecimiento restringido es muy alta. Diferentes estudios muestran que entorno a la mitad de los casos son en realidad embarazos normales.
En la revisión que publicó el recientemente fallecido Masden Wagner en Midwifery Today allá por 1999, (7) recogía diferentes conclusiones al respecto: la palpación abdominal por una comadrona o un médico experimentado son tan precisas en la detección de casos de crecimiento restringido como hacer una ecografía. Esto mismo concluyó un estudio en Suecia que comparaba la medición repetida del útero por la comadrona frente a las mediciones de la cabeza fetal por ecografía, siendo en este caso las comadronas más eficaces que la ecografía. De hecho, la tasa de falsos positivos para los casos de crecimiento restringido es muy alta. Diferentes estudios muestran que entorno a la mitad de los casos son en realidad embarazos normales.
Teniendo en cuenta que el diagnóstico de problemas del crecimiento aumenta exponencialmente las posibilidades de inducción y otras intervenciones innecesarias, las dudas sobre la eficacia de la la ecografía del tercer trimestre está más que justificado. Y más si tenemos en cuenta que solo ciertos programas de nutrición y prevención de addicciones han conseguido prevenir unos pocos casos de problemas del crecimiento fetal. Hacer una ecografía de screening para detectar el CIR solo nos lleva a una mayor tasa de inducción, con los riesgos que esto implica.
De hecho, el uso de ecografías repetidas se ha asociado con una mayor tasa de crecimiento reducido (8)(bien porque la ecografía influya de alguna manera que aun desconocemos, o bien porque haya un sobrediagnóstico). Otro estudio en Reino Unido asociaba el uso de ecografía doppler con un riesgo dos veces mayor de muerte perinatal.(9) De modo que lo más prudente parece ser limitar el número de ecografías a los casos en los que la información obtenida pueda tener importancia clínica.
Pero no solo ocurre el sobrediagnóstico de casos de crecimiento restringido con la ecografía, sino que también podemos caer en el otro lado de la balanza en un sobrediagnóstico de macrosomías.
En la obsesión por el número y por considerar al feto como un cilindro macizo y a la pelvis como un hueco fijo y estándar cuyos respectivos diámetros no son capaces de modificarse con la DINÁMICA (y resalto aquí dinámica, porque el parto no es un proceso estático, ni lo son las dimensiones de sus protagonistas), la ecografía para la estimación del peso fetal se ha convertido en un "must" a la hora de considerar el balance de riesgos.
Se establecen límites de peso fetal estimado para decidir si una cesárea está más indicada que el parto con la excusa de prevenir una posible distocia de hombros, cuando lo cierto es que hasta el 50% de las distocias de hombros ocurren en fetos de peso normal y no pueden predecirse. De hecho, no se ha demostrado que la inducción de parto, ni en mujeres diabéticas ni en no diabéticas con sospecha de macrosomía, influya o reduzca el riesgo de morbilidad materna o neonatal. (10, 11)
¿de qué me sirve diagnosticar una condición si el tratamiento que le aplicaría no tiene ningún beneficio demostrado ni reduce riesgos? Tan solo aumentar la ansiedad materna, la ansiedad de los profesionales y la tendencia al intervencionismo.
 Aunque recientemente se están empezando a aplicar la creación de tablas de crecimiento individualizadas por factores como la raza o las características, lo cierto es que no existe evidencia aún que lo avale. En la mayor parte de los hospitales hoy en día se siguen utilizando tablas estandarizadas de crecimiento fetal, cuando claramente, el factor genético tiene un peso importantísimo. Un bebé de 4,5 kilos para una mujer de 1,90 de estatura igual es lo normal, de la misma manera que un bebé de 2,200 en una mujer de 45 kg puede ser lo normal. Una madre y un padre pequeños, rara vez producen bebés gigantescos y viceversa. Es decir, los pesos fetales se valoran como si el bebé fuera un ser aislado flotando en un vacío, sin una madre y/o un padre detrás.
Aunque recientemente se están empezando a aplicar la creación de tablas de crecimiento individualizadas por factores como la raza o las características, lo cierto es que no existe evidencia aún que lo avale. En la mayor parte de los hospitales hoy en día se siguen utilizando tablas estandarizadas de crecimiento fetal, cuando claramente, el factor genético tiene un peso importantísimo. Un bebé de 4,5 kilos para una mujer de 1,90 de estatura igual es lo normal, de la misma manera que un bebé de 2,200 en una mujer de 45 kg puede ser lo normal. Una madre y un padre pequeños, rara vez producen bebés gigantescos y viceversa. Es decir, los pesos fetales se valoran como si el bebé fuera un ser aislado flotando en un vacío, sin una madre y/o un padre detrás.
Pero no solo eso, sino que la estimación del peso fetal, como toda técnica, tiene sus márgenes de error, y depende mucho de la pericia del ecografista. Los estudios reconocen que, a la hora de estimar el crecimiento fetal, el margen de error en el tercer trimestre es de unos 500 gr o más, y que generalmente se sobreestima. Volviendo al tema de la macrosomía, el valor predictivo positivo (es decir, la capacidad de detectar verdaderos casos), es de tan solo el 50%.(12,13). Dado que esto condiciona la actitud del profesional a la hora de atender el parto, el nivel de error que asumimos no es para tomarlo a la ligera.
Si tan poca es nuestra confianza en la habilidad del cuerpo materno para "producir" un hijo/a sano que tenemos que sobrevigilarlo con ecografías que no han demostrado tener beneficios fuertes a nivel poblacional en la morbimortalidad materna o fetal, aún menos es nuestra confianza en la capacidad del cuerpo para dar a luz a bebés sanos.
 Por eso, desde mediados de los 50, se han ido desarrollando y modificando los métodos de monitorización intraparto y su uso se ha ido generalizado tanto que se podría decir que la inmensa mayoría de mujeres en el mundo desarrollado paren "atadas" a un monitor (con la limitación de la movilidad que eso supone).
Por eso, desde mediados de los 50, se han ido desarrollando y modificando los métodos de monitorización intraparto y su uso se ha ido generalizado tanto que se podría decir que la inmensa mayoría de mujeres en el mundo desarrollado paren "atadas" a un monitor (con la limitación de la movilidad que eso supone).
Cuando la monitorización se ideó inicialmente, el objetivo era ser capaz de detectar a los bebés que podían tener dificultades en el parto, y por tanto, estar en riesgo de desarrollar parálisis cerebral o incluso muerte intraparto. Pero lo cierto es que, ni la mayor parte de las parálisis cerebrales ni las muertes intraútero ocurren en el momento del parto.
De hecho, según el último informe de mortalidad materno fetal en el Reino Unido, tan solo un 8,8% de las muertes intraútero ocurrieron en el momento del parto. (14) La mayor parte de los bebés que fallecen dentro del útero, lo hacen preparto.
Por ese motivo, se ha defendido el uso de monitorización anteparto (test sin estrés) a partir de determinadas semanas de gestación, sin que haya estudios que demuestren a qué intervalo de tiempo deben realizarse, a partir de qué semana o durante cuánto tiempo. De hecho, hacer monitores de manera rutinaria antes del parto tiene un alto índice de falsos positivos, que solo puede ocasionar intervenciones innecesarias.
En cuanto a la parálisis cerebral, existen numerosos estudios que han demostrado que solo un 4% de los casos se deben a hipoxias en el momento del parto, y que la mayoría se producen a consecuencia de lesiones cerebrales anteparto. (15)
Partiendo de los datos que comentaba mas arriba, el uso de monitorización intraparto, si es efectiva, solo ayudaría a reducir 0'37 mueres por cada 1000 nacimientos y menos del 10% de los casos de parálisis cerebral. ¿pero es efectiva? ¿se han conseguido prevenir estos casos?.
Lo cierto es que la monitorización continua electrónica en el parto no ha demostrado beneficios ni mejora en la incidencia de mortalidad perinatal o parálisis cerebral, pero sin embargo ha aumentado en gran medida la tasa de cesáreas y parto instrumental. El único beneficio demostrado de la monitorización es un ligero descenso en las convulsiones neonatales en el período neonatal inmediato, aunque la mayoría de los bebés que las tienen, al final del primer año no tienen secuelas permanentes. (16)
La monitorización continua tiene una baja especificidad como cribado de hypoxemia y acidemia y se ha estimado, que en bebés con peso fetal estimado mayor o igual a 2,5 kg que tenían un monitor clasificado como patológico, la monitorización tiene un valor predictivo positivo para la parálisis cerebral de tan solo un 0,14%. (17)
Pero además, la utilización de la monitorización está sujeta a la interpretación subjetiva de un profesional, que se adhiere a unas clasificaciones que van variando a lo largo de los años, es decir, una de sus mayores limitaciones es la falta de reproductividad inter e intraobservador. (18)
Para mejorar la efectividad, se propuso combinar la monitorización con el test de pH fetal. Dicho test no tiene ni pies ni cabeza ni evidencia científica que lo sustente, como podéis leer aquí. Pero además, la combinación del monitor con el ph fetal tampoco ha demostrado reducir la mortalidad perinatal o la incidencia de parálisis cerebral, pero sí ha aumentado la tasa de cesárea y parto instrumental.
 Actualmente, lo que está de moda es el uso de sistemas informáticos de interpretación de los registros con sistemas como STAN(c) que de momento aún no han tenido tiempo de demostrar si consiguen hacer lo que la monitorización convencional no ha conseguido. Veremos en los próximos años que nos dice la experiencia, pero desde mi punto de vista, el uso de sistemas informáticos solo mejorará la interpretación pero no puede de momento mejorar la especificidad y el valor predictivo positivo. Es decir, STAN(c) podrá ayudarnos a ponernos de acuerdo a la hora de definir registros patológicos, pero de momento no puede diferenciar si un registro patológico esté relacionado con un bebé estresado de verdad o si tan solo es una variación más de la normalidad.
Actualmente, lo que está de moda es el uso de sistemas informáticos de interpretación de los registros con sistemas como STAN(c) que de momento aún no han tenido tiempo de demostrar si consiguen hacer lo que la monitorización convencional no ha conseguido. Veremos en los próximos años que nos dice la experiencia, pero desde mi punto de vista, el uso de sistemas informáticos solo mejorará la interpretación pero no puede de momento mejorar la especificidad y el valor predictivo positivo. Es decir, STAN(c) podrá ayudarnos a ponernos de acuerdo a la hora de definir registros patológicos, pero de momento no puede diferenciar si un registro patológico esté relacionado con un bebé estresado de verdad o si tan solo es una variación más de la normalidad.
Entonces, como también cuestiona Sarah Wickham en su blog, si no hay beneficios positivos del uso de monitorización continua intraparto pero sí que hay claras consecuencias adversas, ¿por qué las guías siguen recomendando su uso? ¿por qué se ha convertido en un pilar básico de nuestra práctica?
De hecho, hemos naturalizado tanto la necesidad de monitorizar el feto que ni si quiera nos hemos cuestionado ni tenemos evidencia ni estudios sobre la frecuencia óptima de auscultación intermitente o incluso si está también es beneficiosa o no. (19)
El profesor Paul Lewis criticaba en un artículo del British Journal of Midwifery las conclusiones de la revisión Cochrane sobre la monitorización de esta manera: la Cochrane defiende que el verdadero reto respecto a la monitorización es informar a las mujeres de esta falta de evidencia para que puedan tomar decisiones informadas pero a la vez no comprometer la normalidad del parto, pero claramente esta conclusión está olvidando el punto clave, y es que es el uso de esta "tecnología basura" lo que en sí está comprometiendo la normalidad del parto y el nacimiento y lo único que hace que la sigamos usando es los intereses particulares que hay detrás. (20)
En la actualidad, en el ámbito europeo está en debate la pertinencia de una ecografía en el tercer trimestre. Mientras que en España (especialmente en el ámbito privado) estamos aumentando cada vez más el uso de ecografía, muchos países se están cuestionando o están eliminando la ecografía rutinaria del tercer trimestre. Quienes defienden su permanencia se basan principalmente en la prevención de casos de crecimiento restringido, que podían aumentar los casos de muerte fetal tardía. Sin embargo, ¿es útil la ecografía para esto?
 En la revisión que publicó el recientemente fallecido Masden Wagner en Midwifery Today allá por 1999, (7) recogía diferentes conclusiones al respecto: la palpación abdominal por una comadrona o un médico experimentado son tan precisas en la detección de casos de crecimiento restringido como hacer una ecografía. Esto mismo concluyó un estudio en Suecia que comparaba la medición repetida del útero por la comadrona frente a las mediciones de la cabeza fetal por ecografía, siendo en este caso las comadronas más eficaces que la ecografía. De hecho, la tasa de falsos positivos para los casos de crecimiento restringido es muy alta. Diferentes estudios muestran que entorno a la mitad de los casos son en realidad embarazos normales.
En la revisión que publicó el recientemente fallecido Masden Wagner en Midwifery Today allá por 1999, (7) recogía diferentes conclusiones al respecto: la palpación abdominal por una comadrona o un médico experimentado son tan precisas en la detección de casos de crecimiento restringido como hacer una ecografía. Esto mismo concluyó un estudio en Suecia que comparaba la medición repetida del útero por la comadrona frente a las mediciones de la cabeza fetal por ecografía, siendo en este caso las comadronas más eficaces que la ecografía. De hecho, la tasa de falsos positivos para los casos de crecimiento restringido es muy alta. Diferentes estudios muestran que entorno a la mitad de los casos son en realidad embarazos normales. Teniendo en cuenta que el diagnóstico de problemas del crecimiento aumenta exponencialmente las posibilidades de inducción y otras intervenciones innecesarias, las dudas sobre la eficacia de la la ecografía del tercer trimestre está más que justificado. Y más si tenemos en cuenta que solo ciertos programas de nutrición y prevención de addicciones han conseguido prevenir unos pocos casos de problemas del crecimiento fetal. Hacer una ecografía de screening para detectar el CIR solo nos lleva a una mayor tasa de inducción, con los riesgos que esto implica.
De hecho, el uso de ecografías repetidas se ha asociado con una mayor tasa de crecimiento reducido (8)(bien porque la ecografía influya de alguna manera que aun desconocemos, o bien porque haya un sobrediagnóstico). Otro estudio en Reino Unido asociaba el uso de ecografía doppler con un riesgo dos veces mayor de muerte perinatal.(9) De modo que lo más prudente parece ser limitar el número de ecografías a los casos en los que la información obtenida pueda tener importancia clínica.
Pero no solo ocurre el sobrediagnóstico de casos de crecimiento restringido con la ecografía, sino que también podemos caer en el otro lado de la balanza en un sobrediagnóstico de macrosomías.
En la obsesión por el número y por considerar al feto como un cilindro macizo y a la pelvis como un hueco fijo y estándar cuyos respectivos diámetros no son capaces de modificarse con la DINÁMICA (y resalto aquí dinámica, porque el parto no es un proceso estático, ni lo son las dimensiones de sus protagonistas), la ecografía para la estimación del peso fetal se ha convertido en un "must" a la hora de considerar el balance de riesgos.
Se establecen límites de peso fetal estimado para decidir si una cesárea está más indicada que el parto con la excusa de prevenir una posible distocia de hombros, cuando lo cierto es que hasta el 50% de las distocias de hombros ocurren en fetos de peso normal y no pueden predecirse. De hecho, no se ha demostrado que la inducción de parto, ni en mujeres diabéticas ni en no diabéticas con sospecha de macrosomía, influya o reduzca el riesgo de morbilidad materna o neonatal. (10, 11)
¿de qué me sirve diagnosticar una condición si el tratamiento que le aplicaría no tiene ningún beneficio demostrado ni reduce riesgos? Tan solo aumentar la ansiedad materna, la ansiedad de los profesionales y la tendencia al intervencionismo.
 Aunque recientemente se están empezando a aplicar la creación de tablas de crecimiento individualizadas por factores como la raza o las características, lo cierto es que no existe evidencia aún que lo avale. En la mayor parte de los hospitales hoy en día se siguen utilizando tablas estandarizadas de crecimiento fetal, cuando claramente, el factor genético tiene un peso importantísimo. Un bebé de 4,5 kilos para una mujer de 1,90 de estatura igual es lo normal, de la misma manera que un bebé de 2,200 en una mujer de 45 kg puede ser lo normal. Una madre y un padre pequeños, rara vez producen bebés gigantescos y viceversa. Es decir, los pesos fetales se valoran como si el bebé fuera un ser aislado flotando en un vacío, sin una madre y/o un padre detrás.
Aunque recientemente se están empezando a aplicar la creación de tablas de crecimiento individualizadas por factores como la raza o las características, lo cierto es que no existe evidencia aún que lo avale. En la mayor parte de los hospitales hoy en día se siguen utilizando tablas estandarizadas de crecimiento fetal, cuando claramente, el factor genético tiene un peso importantísimo. Un bebé de 4,5 kilos para una mujer de 1,90 de estatura igual es lo normal, de la misma manera que un bebé de 2,200 en una mujer de 45 kg puede ser lo normal. Una madre y un padre pequeños, rara vez producen bebés gigantescos y viceversa. Es decir, los pesos fetales se valoran como si el bebé fuera un ser aislado flotando en un vacío, sin una madre y/o un padre detrás. Pero no solo eso, sino que la estimación del peso fetal, como toda técnica, tiene sus márgenes de error, y depende mucho de la pericia del ecografista. Los estudios reconocen que, a la hora de estimar el crecimiento fetal, el margen de error en el tercer trimestre es de unos 500 gr o más, y que generalmente se sobreestima. Volviendo al tema de la macrosomía, el valor predictivo positivo (es decir, la capacidad de detectar verdaderos casos), es de tan solo el 50%.(12,13). Dado que esto condiciona la actitud del profesional a la hora de atender el parto, el nivel de error que asumimos no es para tomarlo a la ligera.
Monitorización intraparto
 Por eso, desde mediados de los 50, se han ido desarrollando y modificando los métodos de monitorización intraparto y su uso se ha ido generalizado tanto que se podría decir que la inmensa mayoría de mujeres en el mundo desarrollado paren "atadas" a un monitor (con la limitación de la movilidad que eso supone).
Por eso, desde mediados de los 50, se han ido desarrollando y modificando los métodos de monitorización intraparto y su uso se ha ido generalizado tanto que se podría decir que la inmensa mayoría de mujeres en el mundo desarrollado paren "atadas" a un monitor (con la limitación de la movilidad que eso supone). Cuando la monitorización se ideó inicialmente, el objetivo era ser capaz de detectar a los bebés que podían tener dificultades en el parto, y por tanto, estar en riesgo de desarrollar parálisis cerebral o incluso muerte intraparto. Pero lo cierto es que, ni la mayor parte de las parálisis cerebrales ni las muertes intraútero ocurren en el momento del parto.
De hecho, según el último informe de mortalidad materno fetal en el Reino Unido, tan solo un 8,8% de las muertes intraútero ocurrieron en el momento del parto. (14) La mayor parte de los bebés que fallecen dentro del útero, lo hacen preparto.
Por ese motivo, se ha defendido el uso de monitorización anteparto (test sin estrés) a partir de determinadas semanas de gestación, sin que haya estudios que demuestren a qué intervalo de tiempo deben realizarse, a partir de qué semana o durante cuánto tiempo. De hecho, hacer monitores de manera rutinaria antes del parto tiene un alto índice de falsos positivos, que solo puede ocasionar intervenciones innecesarias.
En cuanto a la parálisis cerebral, existen numerosos estudios que han demostrado que solo un 4% de los casos se deben a hipoxias en el momento del parto, y que la mayoría se producen a consecuencia de lesiones cerebrales anteparto. (15)
Partiendo de los datos que comentaba mas arriba, el uso de monitorización intraparto, si es efectiva, solo ayudaría a reducir 0'37 mueres por cada 1000 nacimientos y menos del 10% de los casos de parálisis cerebral. ¿pero es efectiva? ¿se han conseguido prevenir estos casos?.
Lo cierto es que la monitorización continua electrónica en el parto no ha demostrado beneficios ni mejora en la incidencia de mortalidad perinatal o parálisis cerebral, pero sin embargo ha aumentado en gran medida la tasa de cesáreas y parto instrumental. El único beneficio demostrado de la monitorización es un ligero descenso en las convulsiones neonatales en el período neonatal inmediato, aunque la mayoría de los bebés que las tienen, al final del primer año no tienen secuelas permanentes. (16)
La monitorización continua tiene una baja especificidad como cribado de hypoxemia y acidemia y se ha estimado, que en bebés con peso fetal estimado mayor o igual a 2,5 kg que tenían un monitor clasificado como patológico, la monitorización tiene un valor predictivo positivo para la parálisis cerebral de tan solo un 0,14%. (17)
Pero además, la utilización de la monitorización está sujeta a la interpretación subjetiva de un profesional, que se adhiere a unas clasificaciones que van variando a lo largo de los años, es decir, una de sus mayores limitaciones es la falta de reproductividad inter e intraobservador. (18)
Para mejorar la efectividad, se propuso combinar la monitorización con el test de pH fetal. Dicho test no tiene ni pies ni cabeza ni evidencia científica que lo sustente, como podéis leer aquí. Pero además, la combinación del monitor con el ph fetal tampoco ha demostrado reducir la mortalidad perinatal o la incidencia de parálisis cerebral, pero sí ha aumentado la tasa de cesárea y parto instrumental.
 Actualmente, lo que está de moda es el uso de sistemas informáticos de interpretación de los registros con sistemas como STAN(c) que de momento aún no han tenido tiempo de demostrar si consiguen hacer lo que la monitorización convencional no ha conseguido. Veremos en los próximos años que nos dice la experiencia, pero desde mi punto de vista, el uso de sistemas informáticos solo mejorará la interpretación pero no puede de momento mejorar la especificidad y el valor predictivo positivo. Es decir, STAN(c) podrá ayudarnos a ponernos de acuerdo a la hora de definir registros patológicos, pero de momento no puede diferenciar si un registro patológico esté relacionado con un bebé estresado de verdad o si tan solo es una variación más de la normalidad.
Actualmente, lo que está de moda es el uso de sistemas informáticos de interpretación de los registros con sistemas como STAN(c) que de momento aún no han tenido tiempo de demostrar si consiguen hacer lo que la monitorización convencional no ha conseguido. Veremos en los próximos años que nos dice la experiencia, pero desde mi punto de vista, el uso de sistemas informáticos solo mejorará la interpretación pero no puede de momento mejorar la especificidad y el valor predictivo positivo. Es decir, STAN(c) podrá ayudarnos a ponernos de acuerdo a la hora de definir registros patológicos, pero de momento no puede diferenciar si un registro patológico esté relacionado con un bebé estresado de verdad o si tan solo es una variación más de la normalidad. Entonces, como también cuestiona Sarah Wickham en su blog, si no hay beneficios positivos del uso de monitorización continua intraparto pero sí que hay claras consecuencias adversas, ¿por qué las guías siguen recomendando su uso? ¿por qué se ha convertido en un pilar básico de nuestra práctica?
De hecho, hemos naturalizado tanto la necesidad de monitorizar el feto que ni si quiera nos hemos cuestionado ni tenemos evidencia ni estudios sobre la frecuencia óptima de auscultación intermitente o incluso si está también es beneficiosa o no. (19)
El profesor Paul Lewis criticaba en un artículo del British Journal of Midwifery las conclusiones de la revisión Cochrane sobre la monitorización de esta manera: la Cochrane defiende que el verdadero reto respecto a la monitorización es informar a las mujeres de esta falta de evidencia para que puedan tomar decisiones informadas pero a la vez no comprometer la normalidad del parto, pero claramente esta conclusión está olvidando el punto clave, y es que es el uso de esta "tecnología basura" lo que en sí está comprometiendo la normalidad del parto y el nacimiento y lo único que hace que la sigamos usando es los intereses particulares que hay detrás. (20)
CONCLUSIONES
Como decía al principio de estas dos entradas temáticas Deconstruyendo paradigmas, la atención obstétrica actual, dentro de la medicina general, ha otorgado todo el mérito de sus éxitos al uso generalizado de antibióticos y de tecnología de diagnóstico prenatal.
Ciertamente, la salud materno fetal ha mejorado drásticamente en los últimos 100 años, pero ¿estamos seguros de qué ha sido por la tecnología médica? Como he ido presentando a lo largo de estas entradas, todavía existe mucha mitología y mucha mitificación de ambos pilares de la obstetricia moderna y poca evidencia. Y es más, aun nos queda mucho por descubrir y mucho terreno donde trabajar.
De hecho, en el último informe de mortalidad perinatal en Reino Unido en 2013 se destacó que los principales factores de riesgo para muerte fetal y neonatal fueron tres:
- La pobreza, que aumentaba el riesgo hasta en un 57%
- La raza negra o asiática, que suelen ser grupos sociales más desfavorecidos que la raza blanca
- La edad materna, tanto madres adolescentes como madres mayores de 40 años.
De hecho, la principal conclusión de este informe fue que los embarazos de las mujeres que viven en las zonas con mayores niveles de deprivación social son las que tienen el doble de probabilidades de acabar en muerte intraútero o muerte neonatal.
¿Pueden los antibióticos y la tecnología de diagnóstico prenatal influir en esos factores?
El reto de la obstetricia en este siglo ya no pasa por ahí y es hora de cambiar el paradigma.
La Organización Mundial de la Salud lleva desde 1974 defendiendo un modelo de salud diferente, pero parece que la Medicina se resiste al cambio. Lalonde ya explicó hace más de 40 años (¡!¡!) que la salud de las poblaciones depende en su mayor parte del estilo de vida y de factores ambientales. Sin embargo, los gobiernos mundiales se empeñan en destinar la mayor parte del gasto sanitario en sistemas de atención sanitaria, que tan solo influyen un 10% en la salud de las poblaciones.
Lo mismo ocurre con la obstetricia. La mayor parte del gasto y el esfuerzo sanitario está destinado al uso de tecnología, de pruebas de screening, de analíticas, que no han conseguido demostrar aún beneficios claros a nivel poblacional, y que además, tan solo pueden influir un 10% en la salud materno infantil.
¿Por qué no cambiamos el modelo de sobrediagnóstico y sobretratamiento por un modelo de empoderamiento en salud? ¿por qué no dejar que las comadronas, las que trabajamos en un paradigma de promoción de salud en lugar de intervención, seamos las que lideremos ese cambio?
Hay que empezar a pensar fuera de la zona de confort, empezar a plantear políticas sociales para acabar con la desigualdad social, políticas de género, políticas de conciliación familiar, políticas de medioambiente y agricultura sostenible, políticas de alimentación y estilos de vida saludables. Hay que cambiar el modelo de intervención biomédico por un modelo de cuidados holítico, integral e integrado, donde la mujer y las familias sean el agente activo del cambio.
Ha llegado el momento de deconstruir el paradigma y darle una vuelta más a la revolución científica.*
*Un libro que siempre recomiendo leer, aunque pueda parecer aburrido es La estructura de las revoluciones científicas, de Thomas Khun. Según este autor, la ciencia cambia no por la ciencia en sí misma, sino por los cambios sociales que la obligan a cambiar y repensar la realidad desde otro punto de vista. ¿es hora ya de una nueva revolución?)
- Wickham S. Anti D: panacea or paradox? Books for Midwives. 2001
- Kresser C. Ultrasound, not as safe as commonly thought. July 2011. Disponible en: http://chriskresser.com/natural-childbirth-iib-ultrasound-not-as-safe-as-commonly-thought/
- Dalecki D et als. Hemolysis in vivo from exposure to pulsed ultrasound. Ultrasound Med Biol. 1997; 23(2):307-13
- Stanton M et als. Diagnostic ultrasound induces change withing numbers of cryptal mitotic and apoptotic cells in small intestine. Life Sci. 2001 Feb 16; 68(13):1471-5
- Campbell JD et als. Case-control study of prenatal ultrasonography exposure in children with delayed speech. CMAJ 1993 Nov 15; 149 (10): 1435-1440
- Grandjean H et als. Sensitivity of routine ultrasound screening of pregnancies in the Eurofetus database. The Eurofetus Team. Ann N Y Acad Sci. 1998 Jun 18; 847:118-24
- Brand IR et als. Specificity of antenatal ultrasound in the Yorkshire Region: a prospective study of 2261 ultrasound detected anormalies. Br J Obstet Gynaecol. 1994 May: 101(5):392-7
- Wagner M. Ultrasound: more harm than good? Midwifery Today. Issue 50, Summer 1999
- Newnham JP et als. Effects of frequent ultrasound during pregnancy: a randomised controlled trial. Lancet 1993 Oct 9; 342(8876):887-91
- Davies JA et als. Randomised controlled trial of Doppler ultrasound screening of placenta perfusion during pregnancy. Lancet 1992 Nov 28; 340(8831):1299-303
- Herbst MA. Treatment of suspected fetal macrosomia: a cost-effectiveness analysis. Am J Obstet Gynecol. 2005 Sep; 193(3 Pt 2):1035-9
- Nesbitt TS et als. Shoulder dystocia and associated risk factors with macrosomic infants born in California. Am J Obstet Gynecol. 1998 Aug; 179(2):476-80
- Delpapa EH et als. Pregnancy outcome following ultrasound diagnosis of macrosomia. Obstet Gynecol. Sep 1991: 78(3Pt1):340-3 (level III)
- Pollack RN et als. Macrosomia in postdates pregnancies: the accuracy of routine ultrasonographic screening. Am J Obstet Gynecol. 1992 Jul; 167(1):7-11
- Manktelow BM, Smith LK, Evans TA, Hyman-Taylor P, Kurinczuk JJ, Field DJ, Smith PW, Draper ES, on behalf of the MBRRACE-UK collaboration. Perinatal Mortality Surveillance Report UK Perinatal Deaths for births from January to December 2013. Leicester: The Infant Mortality and Morbidity Group, Department of Health Sciences, University of Leicester. 2015
- MacLennan AH et als. Cerebral palsy: causes, pathways and the role of genetic variants. Am J Obstet Gynecol. 2015 May 21.
- Alfirevic Z et als. Continuous cardiotocography (CTG) as a form of electronic fetal monitoring (EFM) for fetal assessment during labour. Cochrane Database Syst Rev. 2006 Jul 19:3. CD006066
- ACOG Practice Bulletin No 106: intrapartum fetal heart rate monitoring: nomenclature, interpretation and general management principles. July 2009; 114 (1):192-202
- Chauhan SP et als. Intrapartum nonreassuring fetal heart rate tracing and prediction of adverse outcomes: interobserver variability. Am J Obstet Gynecol 2008 Dec; 199(6): 623.e1-5. Epub 2008 Jul 30
- Liston R et als. Society of Obstetric and Gynecologist of Canada; British Columbia Perinatal Health Program. Fetal health surveillance: antepartum and intrapartum consensus guideline. J Obstet Gynecol Can. 2007 Sep; 29(9 Suppl 4): S3-56
- Lewis P. Room 101 - The only place for fetal monitoring in labour. British Journal of Midwifery. 21(6), p386