Por favor, si quieres compartir el contenido de esta entrada,
nombra siempre la fuente. No te aproveches del trabajo de otrxs,
citar y enlazar esta bien, pero copiar es una
falta de respeto al tiempo y esfuerzo de los demás.
Sobre mortalidad materna se dice que, hasta el siglo XX, las madres y bebés morían como chinches en los partos. Y ciertamente, morían bastante más de las que uno/a desearía. Las fiebres puerperales, los sobrepartos, se llevaban muchas vidas. Se dice también que la generalización del uso de antibióticos fue lo que redujo enormemente la mortalidad materna.
Lo que no se suele mencionar es que esas fiebres las causaban las mismas personas que atendían los partos. Como nos recuerda Juan Gervás, fueron las matronas suecas las que al facilitar un parto con poca intervención y mediante el uso de lavado de manos, lograron bajar la mortalidad materna a la cuarta parte que en otros países desarrollados.(1) Pero esta historia es la que no se cuenta. Reconocer que los profesionales eran los mismos que causaban esas enfermedades nos deja en muy mal lugar.
 Por eso siempre se ha enfatizado en la idea de que la mortalidad materna disminuyó drásticamente a partir del siglo XIX por el uso de antibióticos y el desarrollo de tecnología de diagnóstico prenatal.
Por eso siempre se ha enfatizado en la idea de que la mortalidad materna disminuyó drásticamente a partir del siglo XIX por el uso de antibióticos y el desarrollo de tecnología de diagnóstico prenatal.
Si nos ponemos a pensar, toda la atención obstétrica (y no solo obstétrica, la medicina en general) hoy en día sigue girando frente a esos dos grandes pilares: los antibióticos y el uso de tecnología. No digo yo que los medios curativos y diagnósticos no sean eficaces, pero a veces tengo la sensación de que hemos empezado a saltarnos pasos en la cadena de atención a la salud (sí, aquella famosa promoción-prevención-curación), yendo directamente al tratamiento, como si lo que hicieramos fueran soluciones milagrosas sin riesgos asociados.
La medicina, al menos en obstetricia, está ante una oportunidad de oro para deconstruirse y cambiar de paradigma. Y digo la medicina, porque lo mismo que pasó con las matronas suecas que empezaron a lavarse las manos antes de que Semmelweis se llevara el mérito, las matronas modernas estamos ya avanzando en esos pasos de cambio de paradigma, aunque a veces parece que hablemos de "miasmas".
Apoyadas por la investigación maravillosa de tantas y tantas disciplinas, somos muchas comadronas las que ya nos planteamos si tanto antibiótico, la nueva agua bendita del siglo XXI, más que salvar vidas, las esté empezando a poner en peligro. Los nuevos descubrimientos sobre la flora bacteriana y sus efectos en la salud empiezan a cuestionar el uso tan extendido de antibióticos.
¿no será mejor prevenir que curar? Reducir la mortalidad por sepsis materno-infantil no tiene por qué necesariamente pasar por el uso de antibióticos, ¿qué tal si empezamos a promocionar la salud? ¿qué tal si cultivamos una flora sana que nos proteja?
Rachel Reed, comadrona independiente australiana, es una de esas matronas. El pasado enero compartía en su blog una maravillosa revisión (2) sobre el tema que traduzco y comparto parcialmente en esta entrada.
Pero antes de eso, partamos de 4 ideas básicos y que no debemos olvidar al hablar del uso de antibióticos:
Los antibióticos matan las bacterias sin preguntarles si lo que hacen en el cuerpo es bueno o malo, y no se aplican a una zona reducida, sino que circulan en tu torrente sanguíneo por todo tu cuerpo: los antibióticos que tomas para una infección de orina en la vejiga, también llegan a tu vagina, a tu estómago, a tu intestino. Si matan a las bacterias de tu vagina, los nutrientes y el sitio quedarán disponibles, y crecerán otros seres vivos. (por eso es tan frecuente tener candidiasis después de tomar antibióticos: como matamos las lactobacterias "buenas" de la vagina, el hongo se queda con el nicho ecológico y crece a sus anchas).
Las bacterias no sólo pueden causar infecciones, la inmensa mayoría de ellas forman algo que, como dice Rachel Reed, está muy de moda últimamente en el mundo científico, y que está empezando a conocerse como "el órgano olvidado".
El órgano olvidado: la microbiota
La microbiota es la inmensa comunidad de bacterias que viven en tu cuerpo e intervienen, de una manera que aún no terminamos de entender, en las principales funciones de regulación con el fin de mantener el equilibrio del sistema (la homeostasis, o lo que es lo mismo, la vida): son bacterias que viven en nosotros para mantenernos vivos y sanos.
Cada persona tiene una microbiota diferente, ya que la vamos adquiriendo durante nuestra vida. Es como nuestra huella dactilar bacteriana. La microbiota que tenemos depende del entorno que nos rodea, por eso nuestra familia tiene una microbiota similar, pero sobre todo, estamos empezando a descubrir que el modo en que nacemos, cómo nos alimentamos los primeros meses de vida y qué ocurrió durante nuestro embarazo, es esencial para la formación de este órgano olvidado.
Un nuevo campo fascinante está por descubrir. Muchas de las (pocas) cosas que sabemos de la microbiota están siendo descubiertas ahora. No ha sido hasta que hemos desarrollado la tecnología de secuenciación genética que hemos sido capaces de ver este increíble microuniverso. La mayoría de estas bacterias no pueden ser cultivadas en un laboratorio con los métodos tradicionales.

La mayor densidad bacteriana se encuentra en el tracto digestivo. Las bacterias de nuestro intestino se sabía que participaban muy activamente como barrera de defensa y regulación de nuestro sistema inmune, pero ahora estamos descubriendo que también influye en nuestro metabolismo, la regulación hormonal e incluso, por medio de feedback, en nuestras emociones.
Por eso, se sabe que una alteración de la microbiota intestinal se ha relacionado con diferentes enfermedades con cierto componente inmune-metabólico, como la inflamación intestinal, enterocolitis necrotizante (que provoca gran mortalidad en bebés prematuros), diabetes, obesidad, cáncer, alergias y asma. (3)
La pregunta que sigue ahora es: ¿qué constituye una microbiota sana o "ideal"? y ¿cómo se forma? ¿qué factores influyen?
Las semillas de la microbiota
Se puede decir que todos los estudios descriptivos de la microbiota diferencian tres tipos principales de bacterias: las proteobacterias (E coli, enterobacter y otras), lactobacterias (lactobacilos y lactococos entre otras) y acetobacterias (bifidobacterias entre otras).
Las lactobacterias y bifidobacterias se consideran las bacterias más importantes para la salud mientras que las bacterias del grupo de las proteobacterias (y otras como los staphylocosos y el género clostridium) pueden causar enfermedades, no solo de tipo infeccioso.
Las proteobacterias producen una sustancia que actúa como una endotoxina inflamatoria que se ha relacionado con varias enfermedades metabólicas. La dominancia de enterobacterias en la infancia se ha relacionado con alergia y eccema y se sabe que la presencia de enteropatógenos como E Coli exacerban la respuesta al estrés.(4,5). Las lactobacterias y bifidobacterias no solo protegen frente a alergias, sino que han probado atenuar la respuesta al estrés.(5)
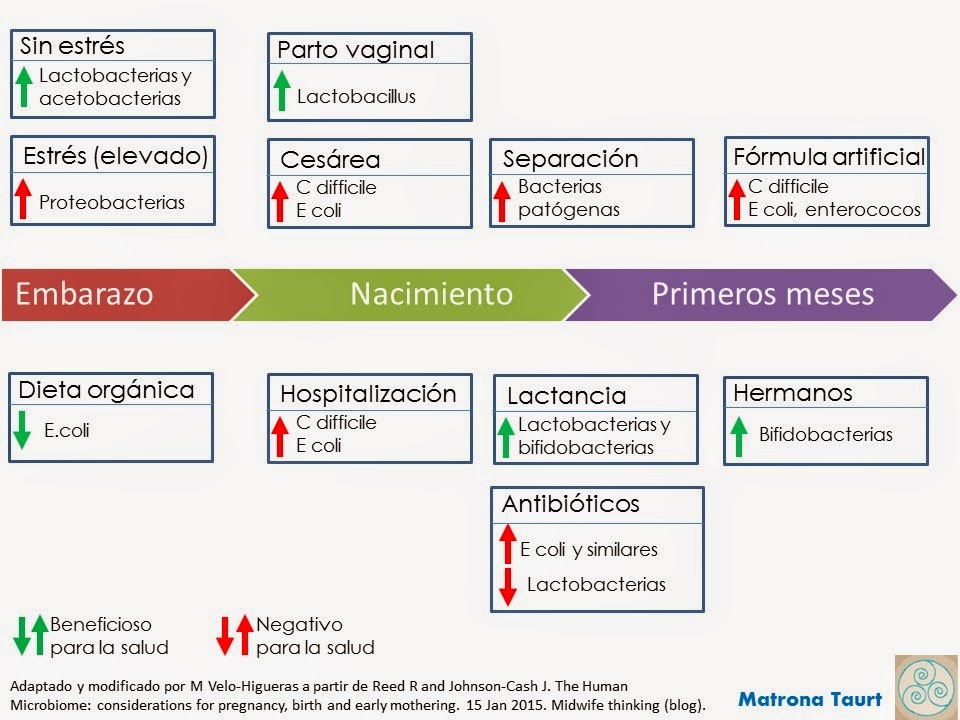
No se trata entonces de no tener proteobacterias, sino que las bacterias dominantes sean de los otros dos grupos. El que tengamos unas u otras depende de múltiples factores (y seguro que de muchos más que aun no conocemos), pero todos los estudios apuntan a que la etapa prenatal, el nacimiento y los primeros meses de vida son determinantes y a su vez tendrán una influencia definitiva en nuestra salud futura.
EMBARAZO
Como apunta Rachel Reed, es una creencia común que el medio intrauterino es estéril y el intestino fetal está vacío de bacterias. Sin embargo, debemos reconocer que todavía desconocemos casi todo del funcionamiento selectivo de la placenta. Si aún ahora estamos empezando a dibujar el universo de la microbiota infantil, ¡qué no nos quedará por aprender sobre la vida dentro del útero!
La investigación está aún en pañales, pero ya hay algunos artículos que apuntan a que el líquido amniótico y la placenta, contienen bacterias "saludables" y que solo cuando existen bacterias patógenas, es cuando se producen las infecciones(6). De hecho, el perfil microbiológico de la placenta se parece bastante al perfil microbiologico de la boca (¿será por eso que besar y lamer a las crías al nacer es una manera de potenciar y asegurar el mantenimiento de la misma flora a la que el bebé estuvo expuesto intraútero?)
El microbioma placentario puede verse influido por la presencia de infecciones prenatales (como una infección de orina), por lo que es razonable pensar que el uso de antibióticos durante el embarazo pueda influir en la formación del microbioma fetal al transformar el materno. (7)
Una flora intestinal sana en la madre podría transmitirse a la descendencia. Parece que la microbiota intestinal materna es capaz de pasar la placenta a través del torrente sanguíneo. Aunque los estudios son mayoritariamente en experimentación animal, empiezan a apuntar que es posible que ni el líquido amniótico ni el meconio fuera tan estéril como pensamos (por cierto, uno de ellos es un estudio español!) (8).
La alimentación de la madre también influye en qué tipo de bacterias colonizarán a sus hijos/as. Los hijos de madres que consumían dieta orgánica o biodinámica parecen tener un menor número de E. coli en sus heces. Se cree que esto puede deberse a que la comida producida de manera orgánica incluye mayor número de vegetales que fermentan espontáneamente conteniendo lactobacilos. Es cierto que el efecto de la dieta materna en la microbiota infantil aún no se puede afirmar del todo, puesto que existen muchos factores de confusión, como el hecho de que las madres que siguen este tipo de alimentación, también suelen amamantar de manera exclusiva en mayor porcentaje que las mujeres que hacen dieta "normal".(4)
Pero uno de los factores que se está descubriendo que más influye a nivel prenatal, no solo ya en la formación de la microbiota, sino en el desarrollo del feto en general, es la exposición a esa pandemia de Occidente: el estrés materno durante el embarazo.
El intestino también se está empezando a denominar "el segundo cerebro". Entre las células del sistema nervioso central y el intestino se establece una comunicación bidireccional. (por eso las enfermedades intestinales pueden aparecer o empeorar en tiempos de estrés).
Esta relación puede deberse a la hormona por excelencia del estrés: el cortisol. El cortisol tiene múltiples efectos, pero a nosotros nos interesan los siguientes:
Y no solo eso, sino que el 43% de los bebés habían tenido algún tipo de reacción alérgica (frente a ninguno en el grupo con bajo estrés prenatal). Los bebés que tienen reacciones alérgicas tienen menor cantidad de bacterias del tipo lactobacterias.(5)
Una exposición alta al estrés durante el embarazo se relaciona con una mayor abundancia de proteobacterias, mientras que los bebés que habían vivido un embarazo sin estrés tenían más lactobacterias y acetobacterias.(5)
NACIMIENTO
Si hay un momento clave en la formación de la microbiota, ese es el nacimiento. Una cascada de "nuevas" bacterias inunda el cuerpo del bebé y se multiplica rápidamente. El bebé recién nacido, es inmunitariamente "débil" y necesita de un ejército de bacterias que pongan a funcionar y entrenen ese sistema inmune. Las primeras bacterias que llegan son bacterias facultativas anaerobias (que se adaptan a condiciones tanto pobres como ricas en oxígeno) y en los siguientes 2-3 días, son sustituidas por anaerobios.
Uno de los factores más estudiados ha sido el nacimiento por cesárea vs el nacimiento por vía vaginal. Se sabe que los bebés nacidos por cesárea tienen menor número de bifidobacterias y sin embargo tienen un número significativamente mayor de C difficile (incluso 100 veces más que los bebés nacidos en casa) y de E coli. Ambas bacterias son comunes en el ambiente hospitalario y responsables de la mayoría de infecciones adquiridas durante una estancia en el hospital.
Por eso, no solo los bebés nacidos por cesárea tienen más abundancia de estas bacterias. Los bebés nacidos por vía vaginal en el hospital también las presentan más que los bebés nacidos en casa.(4) El desplazamiento del nacimiento del propio entorno del bebé ha podido empeorar la salud de la población de manera global, a exponer a bebés y madres sanas a bacterias de personas enfermas, transmitidas por las manos de los profesionales, el material del hospital e incluso las sábanas de las camas.
Esta misma es la base de la mayor presencia de este tipo de bacterias en bebés prematuros, no por la prematuridad en sí misma, sino por la hospitalización que supone en muchas ocasiones y la separación de su "nicho biológico", la madre (con su flora microbiana "sana"), que es sustituida por tecnología médica contaminada con bacterias patógenas.
El piel con piel debería ser la medida estándar de cuidado (para todos los bebés, incluidos los nacidos a término y sanos) y las incubadoras y cunas relegadas a medidas secundarias cuando lo primero no es posible (en lugar de lo que ocurre ahora, que los bebés pasan más horas en la cuna/incubadora que sobre la piel de sus madres). Mientras el bebé está piel con piel, las bacterias maternas (ante las cuales su madre también le transmitió inmunidad por la placenta) colonizarán su piel, su boca, su intestino. Sin embargo, un bebé alejado del cuerpo de su madre se queda vulnerable frente a bacterias desconocidas y ante las que no tiene inmunidad.
Por desgracia, más habitualmente en el ambiente hospitalario que en casa, cuando el bebé está cultivando su nueva microbiota saludable, muchas veces se ve expuesto a antibióticos, que como decía al inicio de esta entrada, no diferencian entre tipos de bacterias y eliminan tanto las patógenas como las saludables. En ciertos estudios, casi la mitad de las madres recibieron antibiótico durante el parto por algún motivo u otro.(9)
Los bebés tratados con antibióticos en las primeras semanas de vida (amoxicilina principalmente) tienen más bacterias de E.coli y otros organismos similares y menor abundancia de lactobacterias. Los antimicóticos también tienen un efecto similar, lo que podría cuestionar el tratamiento con miconazol oral para la llamada candidiasis del pezón (por cierto, mal nombrada, ya que es una infección bacteriana y no fúngica. Para más info, ver esta estupenda entrada de Alba Lactancia Materna). (4)
Y mientras atacamos la estadísticamente-posible infección (la mayoría de los antibióticos hoy en día los estamos dando de manera profiláctica, no realmente ante una infección presente), privamos a los recién nacidos de la primera barrera de defensa que la naturaleza ha estado desarrollando durante millones de años de evolución con el fin de mantenernos no solo vivos, sino además sanos: el vérmix.
El vérmix, esa "crema" grasa y pegajosa que cubre el cuerpo del bebé y que tan generosamente retiramos con una toalla cuando nace el bebé o nos empeñamos en bañarle con jabones y demás químicos a las pocas horas de nacer, es una compleja barrera de defensa innata crucial. El vérmix tiene propiedades antimicrobianas que no solo bloquean la colonización de microbios patógenos indeseados, sino que además favorece y facilita la colonización de la flora normal.
La vermix es activa frente al hongo C albicans, pero lo que es más interesante, en estudios de laboratorio, un 78% de las muestras eran activas frente al estreptococo betahemolítico (SGB) (por el cual muchos bebés y madres se llevan antibióticos durante el parto) y un 31% frente a E. Coli. (10) El vermix es especialmente activo frente al SGB, ¿por qué no en vez de antibióticos intraparto dejamos a los bebés con su vermix intacto?
El vermix tiene ácidos grasos que inhiben las bacterias gram positivo y otros ácidos grasos (como el palmolítico y el linoleico) de conocida acción antimicrobiana, que son capaces de desintegrar la membrana de los virus y de las bacterias.(10)
PRIMEROS MESES
Si el parto es importante, puesto que es la primera cascada de bacterias, los primeros meses de vida no son menos importantes. Es el momento de estabilizar, cultivar y establecer una microbiota sana, que proteja al bebé durante toda su vida. De nuevo, la naturaleza es sabia y ha desarrollado mecanismos extremadamente eficaces para conseguirlo.
El calostro es el primero de ellos. No solo proporciona microbios vivos (bifidobacterias y lactobacterias principalmente), sino además asegura que estos tengan un amplio espectro de sustancias bioactivas que aseguren su supervivencia.(11) Esto a su vez induce respuestas específicas de los linfocitos T, lo que tiene un gran impacto en el desarrollo de la función inmune y la tolerancia oral.
Ninguna fórmula artificial es capaz hoy en día de siquiera imitar tan magnífico mecanismo de defensa. De hecho, uno de los mayores riesgos de las fórmulas es la contaminación bacteriana. Esto explica que la incidencia de C difficile, streptococcus, E Coli, pseudomonas aeruginosa y enterococos faecalis sea significativamente más alta en bebés alimentados con fórmula que en bebés alimentados con lactancia materna exclusiva.(12, 4, 9)
Los bebés alimentados con leche materna tienen una población más estable y uniforme de bacterias que los bebés alimentados con fórmula, sin embargo, cantidades relativamente pequeñas de suplementos de fórmula pueden generar que el patrón de bebé de pecho se cambie a un patrón de bebé de fórmula.(9)
Promocionar la microbiota, promocionar la salud
Aun hay mucho que investigar, todavía no estamos sino descubriendo el principio de algo que, en mi opinión, puede revolucionar el paradigma en obstetricia. Quizás, dentro de unos años, si promocionamos una microbiota saludable en madres y bebés, podamos promocionar globalmente la salud, no solo materno-infatil, sino poblacional a largo plazo.
La influencia del abuso de antibióticos, no solo por la creación de superbacterias resistentes a cada vez más antibióticos, sino por la destrucción de la microbiota sana, puede tener consecuencias devastadoras en la salud de las poblaciones. Quizás dentro de unos años, si cultivamos una microbiota sana, no necesitemos tantos antibióticos, o al menos nos lo pensemos un par de veces antes de prescribirlos como si fueran agua.
Aunque en algunos puntos no existe aún evidencia suficientemente fuerte, podemos empezar a pensar e intuir recomendaciones para, como comadronas, empezar los primeros pasos en el cambio de paradigma.
Actualización Abril 2015:
Justo un día después de publicar esta entrada, se publicó una noticia sobre un estudio americano que describe como determinados genes en la madre, hacen que produzca ciertos azúcares en la leche específicos para alimentar determinado tipo de bacterias (bifidobacterias) y favorecer su colonización. Podéis consultar el artículo completo aquí.
Bibliografía
¿no será mejor prevenir que curar? Reducir la mortalidad por sepsis materno-infantil no tiene por qué necesariamente pasar por el uso de antibióticos, ¿qué tal si empezamos a promocionar la salud? ¿qué tal si cultivamos una flora sana que nos proteja?
Rachel Reed, comadrona independiente australiana, es una de esas matronas. El pasado enero compartía en su blog una maravillosa revisión (2) sobre el tema que traduzco y comparto parcialmente en esta entrada.
Pero antes de eso, partamos de 4 ideas básicos y que no debemos olvidar al hablar del uso de antibióticos:
- Los antibióticos matan bacterias
- Los antibióticos de amplio espectro (los más usados) no distinguen el tipo de bacteria
- Un nicho ecológico (un espacio biológicamente habitable), si está vacío, pronto será ocupado por el que llegue antes o el que sea más fuerte.
- Las bacterias de tu cuerpo superan en 10 veces al número de células de tu cuerpo
Los antibióticos matan las bacterias sin preguntarles si lo que hacen en el cuerpo es bueno o malo, y no se aplican a una zona reducida, sino que circulan en tu torrente sanguíneo por todo tu cuerpo: los antibióticos que tomas para una infección de orina en la vejiga, también llegan a tu vagina, a tu estómago, a tu intestino. Si matan a las bacterias de tu vagina, los nutrientes y el sitio quedarán disponibles, y crecerán otros seres vivos. (por eso es tan frecuente tener candidiasis después de tomar antibióticos: como matamos las lactobacterias "buenas" de la vagina, el hongo se queda con el nicho ecológico y crece a sus anchas).
Las bacterias no sólo pueden causar infecciones, la inmensa mayoría de ellas forman algo que, como dice Rachel Reed, está muy de moda últimamente en el mundo científico, y que está empezando a conocerse como "el órgano olvidado".
El órgano olvidado: la microbiota
La microbiota es la inmensa comunidad de bacterias que viven en tu cuerpo e intervienen, de una manera que aún no terminamos de entender, en las principales funciones de regulación con el fin de mantener el equilibrio del sistema (la homeostasis, o lo que es lo mismo, la vida): son bacterias que viven en nosotros para mantenernos vivos y sanos.
Cada persona tiene una microbiota diferente, ya que la vamos adquiriendo durante nuestra vida. Es como nuestra huella dactilar bacteriana. La microbiota que tenemos depende del entorno que nos rodea, por eso nuestra familia tiene una microbiota similar, pero sobre todo, estamos empezando a descubrir que el modo en que nacemos, cómo nos alimentamos los primeros meses de vida y qué ocurrió durante nuestro embarazo, es esencial para la formación de este órgano olvidado.
Un nuevo campo fascinante está por descubrir. Muchas de las (pocas) cosas que sabemos de la microbiota están siendo descubiertas ahora. No ha sido hasta que hemos desarrollado la tecnología de secuenciación genética que hemos sido capaces de ver este increíble microuniverso. La mayoría de estas bacterias no pueden ser cultivadas en un laboratorio con los métodos tradicionales.

La mayor densidad bacteriana se encuentra en el tracto digestivo. Las bacterias de nuestro intestino se sabía que participaban muy activamente como barrera de defensa y regulación de nuestro sistema inmune, pero ahora estamos descubriendo que también influye en nuestro metabolismo, la regulación hormonal e incluso, por medio de feedback, en nuestras emociones.
Por eso, se sabe que una alteración de la microbiota intestinal se ha relacionado con diferentes enfermedades con cierto componente inmune-metabólico, como la inflamación intestinal, enterocolitis necrotizante (que provoca gran mortalidad en bebés prematuros), diabetes, obesidad, cáncer, alergias y asma. (3)
La pregunta que sigue ahora es: ¿qué constituye una microbiota sana o "ideal"? y ¿cómo se forma? ¿qué factores influyen?
Las semillas de la microbiota
Se puede decir que todos los estudios descriptivos de la microbiota diferencian tres tipos principales de bacterias: las proteobacterias (E coli, enterobacter y otras), lactobacterias (lactobacilos y lactococos entre otras) y acetobacterias (bifidobacterias entre otras).
Las lactobacterias y bifidobacterias se consideran las bacterias más importantes para la salud mientras que las bacterias del grupo de las proteobacterias (y otras como los staphylocosos y el género clostridium) pueden causar enfermedades, no solo de tipo infeccioso.
Las proteobacterias producen una sustancia que actúa como una endotoxina inflamatoria que se ha relacionado con varias enfermedades metabólicas. La dominancia de enterobacterias en la infancia se ha relacionado con alergia y eccema y se sabe que la presencia de enteropatógenos como E Coli exacerban la respuesta al estrés.(4,5). Las lactobacterias y bifidobacterias no solo protegen frente a alergias, sino que han probado atenuar la respuesta al estrés.(5)
No se trata entonces de no tener proteobacterias, sino que las bacterias dominantes sean de los otros dos grupos. El que tengamos unas u otras depende de múltiples factores (y seguro que de muchos más que aun no conocemos), pero todos los estudios apuntan a que la etapa prenatal, el nacimiento y los primeros meses de vida son determinantes y a su vez tendrán una influencia definitiva en nuestra salud futura.
EMBARAZO
Como apunta Rachel Reed, es una creencia común que el medio intrauterino es estéril y el intestino fetal está vacío de bacterias. Sin embargo, debemos reconocer que todavía desconocemos casi todo del funcionamiento selectivo de la placenta. Si aún ahora estamos empezando a dibujar el universo de la microbiota infantil, ¡qué no nos quedará por aprender sobre la vida dentro del útero!
La investigación está aún en pañales, pero ya hay algunos artículos que apuntan a que el líquido amniótico y la placenta, contienen bacterias "saludables" y que solo cuando existen bacterias patógenas, es cuando se producen las infecciones(6). De hecho, el perfil microbiológico de la placenta se parece bastante al perfil microbiologico de la boca (¿será por eso que besar y lamer a las crías al nacer es una manera de potenciar y asegurar el mantenimiento de la misma flora a la que el bebé estuvo expuesto intraútero?)
El microbioma placentario puede verse influido por la presencia de infecciones prenatales (como una infección de orina), por lo que es razonable pensar que el uso de antibióticos durante el embarazo pueda influir en la formación del microbioma fetal al transformar el materno. (7)
Una flora intestinal sana en la madre podría transmitirse a la descendencia. Parece que la microbiota intestinal materna es capaz de pasar la placenta a través del torrente sanguíneo. Aunque los estudios son mayoritariamente en experimentación animal, empiezan a apuntar que es posible que ni el líquido amniótico ni el meconio fuera tan estéril como pensamos (por cierto, uno de ellos es un estudio español!) (8).
La alimentación de la madre también influye en qué tipo de bacterias colonizarán a sus hijos/as. Los hijos de madres que consumían dieta orgánica o biodinámica parecen tener un menor número de E. coli en sus heces. Se cree que esto puede deberse a que la comida producida de manera orgánica incluye mayor número de vegetales que fermentan espontáneamente conteniendo lactobacilos. Es cierto que el efecto de la dieta materna en la microbiota infantil aún no se puede afirmar del todo, puesto que existen muchos factores de confusión, como el hecho de que las madres que siguen este tipo de alimentación, también suelen amamantar de manera exclusiva en mayor porcentaje que las mujeres que hacen dieta "normal".(4)
Pero uno de los factores que se está descubriendo que más influye a nivel prenatal, no solo ya en la formación de la microbiota, sino en el desarrollo del feto en general, es la exposición a esa pandemia de Occidente: el estrés materno durante el embarazo.
El intestino también se está empezando a denominar "el segundo cerebro". Entre las células del sistema nervioso central y el intestino se establece una comunicación bidireccional. (por eso las enfermedades intestinales pueden aparecer o empeorar en tiempos de estrés).
Esta relación puede deberse a la hormona por excelencia del estrés: el cortisol. El cortisol tiene múltiples efectos, pero a nosotros nos interesan los siguientes:
- Interviene como modulador del sistema inmune (a menudo lo deprime)
- Modifica la permeabilidad intestinal, alterando la función de barrera y potencialmente influyendo en la microbiota.
- Puede cruzar la barrera placentaria y aumentar el cortisol fetal, por lo que los bebés expuestos al estrés prenatalmente nacen con niveles más elevados de cortisol y además reaccionan más ante este. (son bebés que lloran más, que son más difíciles de calmar, nacen "asustados o estresados").
- Altera la producción de ácidos biliares, lo que además de interferir con el desarrollo natural de la microbiota en el embarazo, ¿podría influir en el desarrollo de complicaciones como la colestasis obstétrica?
Y no solo eso, sino que el 43% de los bebés habían tenido algún tipo de reacción alérgica (frente a ninguno en el grupo con bajo estrés prenatal). Los bebés que tienen reacciones alérgicas tienen menor cantidad de bacterias del tipo lactobacterias.(5)
Una exposición alta al estrés durante el embarazo se relaciona con una mayor abundancia de proteobacterias, mientras que los bebés que habían vivido un embarazo sin estrés tenían más lactobacterias y acetobacterias.(5)
NACIMIENTO
Si hay un momento clave en la formación de la microbiota, ese es el nacimiento. Una cascada de "nuevas" bacterias inunda el cuerpo del bebé y se multiplica rápidamente. El bebé recién nacido, es inmunitariamente "débil" y necesita de un ejército de bacterias que pongan a funcionar y entrenen ese sistema inmune. Las primeras bacterias que llegan son bacterias facultativas anaerobias (que se adaptan a condiciones tanto pobres como ricas en oxígeno) y en los siguientes 2-3 días, son sustituidas por anaerobios.
Uno de los factores más estudiados ha sido el nacimiento por cesárea vs el nacimiento por vía vaginal. Se sabe que los bebés nacidos por cesárea tienen menor número de bifidobacterias y sin embargo tienen un número significativamente mayor de C difficile (incluso 100 veces más que los bebés nacidos en casa) y de E coli. Ambas bacterias son comunes en el ambiente hospitalario y responsables de la mayoría de infecciones adquiridas durante una estancia en el hospital.
Por eso, no solo los bebés nacidos por cesárea tienen más abundancia de estas bacterias. Los bebés nacidos por vía vaginal en el hospital también las presentan más que los bebés nacidos en casa.(4) El desplazamiento del nacimiento del propio entorno del bebé ha podido empeorar la salud de la población de manera global, a exponer a bebés y madres sanas a bacterias de personas enfermas, transmitidas por las manos de los profesionales, el material del hospital e incluso las sábanas de las camas.
Esta misma es la base de la mayor presencia de este tipo de bacterias en bebés prematuros, no por la prematuridad en sí misma, sino por la hospitalización que supone en muchas ocasiones y la separación de su "nicho biológico", la madre (con su flora microbiana "sana"), que es sustituida por tecnología médica contaminada con bacterias patógenas.
El piel con piel debería ser la medida estándar de cuidado (para todos los bebés, incluidos los nacidos a término y sanos) y las incubadoras y cunas relegadas a medidas secundarias cuando lo primero no es posible (en lugar de lo que ocurre ahora, que los bebés pasan más horas en la cuna/incubadora que sobre la piel de sus madres). Mientras el bebé está piel con piel, las bacterias maternas (ante las cuales su madre también le transmitió inmunidad por la placenta) colonizarán su piel, su boca, su intestino. Sin embargo, un bebé alejado del cuerpo de su madre se queda vulnerable frente a bacterias desconocidas y ante las que no tiene inmunidad.
Por desgracia, más habitualmente en el ambiente hospitalario que en casa, cuando el bebé está cultivando su nueva microbiota saludable, muchas veces se ve expuesto a antibióticos, que como decía al inicio de esta entrada, no diferencian entre tipos de bacterias y eliminan tanto las patógenas como las saludables. En ciertos estudios, casi la mitad de las madres recibieron antibiótico durante el parto por algún motivo u otro.(9)
Los bebés tratados con antibióticos en las primeras semanas de vida (amoxicilina principalmente) tienen más bacterias de E.coli y otros organismos similares y menor abundancia de lactobacterias. Los antimicóticos también tienen un efecto similar, lo que podría cuestionar el tratamiento con miconazol oral para la llamada candidiasis del pezón (por cierto, mal nombrada, ya que es una infección bacteriana y no fúngica. Para más info, ver esta estupenda entrada de Alba Lactancia Materna). (4)
Y mientras atacamos la estadísticamente-posible infección (la mayoría de los antibióticos hoy en día los estamos dando de manera profiláctica, no realmente ante una infección presente), privamos a los recién nacidos de la primera barrera de defensa que la naturaleza ha estado desarrollando durante millones de años de evolución con el fin de mantenernos no solo vivos, sino además sanos: el vérmix.
El vérmix, esa "crema" grasa y pegajosa que cubre el cuerpo del bebé y que tan generosamente retiramos con una toalla cuando nace el bebé o nos empeñamos en bañarle con jabones y demás químicos a las pocas horas de nacer, es una compleja barrera de defensa innata crucial. El vérmix tiene propiedades antimicrobianas que no solo bloquean la colonización de microbios patógenos indeseados, sino que además favorece y facilita la colonización de la flora normal.
La vermix es activa frente al hongo C albicans, pero lo que es más interesante, en estudios de laboratorio, un 78% de las muestras eran activas frente al estreptococo betahemolítico (SGB) (por el cual muchos bebés y madres se llevan antibióticos durante el parto) y un 31% frente a E. Coli. (10) El vermix es especialmente activo frente al SGB, ¿por qué no en vez de antibióticos intraparto dejamos a los bebés con su vermix intacto?
El vermix tiene ácidos grasos que inhiben las bacterias gram positivo y otros ácidos grasos (como el palmolítico y el linoleico) de conocida acción antimicrobiana, que son capaces de desintegrar la membrana de los virus y de las bacterias.(10)
PRIMEROS MESES
Si el parto es importante, puesto que es la primera cascada de bacterias, los primeros meses de vida no son menos importantes. Es el momento de estabilizar, cultivar y establecer una microbiota sana, que proteja al bebé durante toda su vida. De nuevo, la naturaleza es sabia y ha desarrollado mecanismos extremadamente eficaces para conseguirlo.
El calostro es el primero de ellos. No solo proporciona microbios vivos (bifidobacterias y lactobacterias principalmente), sino además asegura que estos tengan un amplio espectro de sustancias bioactivas que aseguren su supervivencia.(11) Esto a su vez induce respuestas específicas de los linfocitos T, lo que tiene un gran impacto en el desarrollo de la función inmune y la tolerancia oral.
Ninguna fórmula artificial es capaz hoy en día de siquiera imitar tan magnífico mecanismo de defensa. De hecho, uno de los mayores riesgos de las fórmulas es la contaminación bacteriana. Esto explica que la incidencia de C difficile, streptococcus, E Coli, pseudomonas aeruginosa y enterococos faecalis sea significativamente más alta en bebés alimentados con fórmula que en bebés alimentados con lactancia materna exclusiva.(12, 4, 9)
Los bebés alimentados con leche materna tienen una población más estable y uniforme de bacterias que los bebés alimentados con fórmula, sin embargo, cantidades relativamente pequeñas de suplementos de fórmula pueden generar que el patrón de bebé de pecho se cambie a un patrón de bebé de fórmula.(9)
No existe mucha información sobre los cambios en la composición de la microbiota intestinal con el destete temprano y tras la introducción de la alimentación complementaria temprana.(11) Pero puesto que al introducir otros alimentos, la microbiota de bebés alimentados a pecho se empieza a parecer a la bebés alimentados con fórmula,(12) cabe suponer que, cuanto más se prolongue la lactancia materna, más estable permanecerá la población de lactobacilos.
De la misma manera, al igual que la microbiota adulta se mantiene más "sana" con una dieta orgánica y biodinámica, cabe suponer que si al introducir la alimentación complementaria se inicia ese tipo de dieta, la microbiota se mantendrá "sana" y se minimizará la "contaminación" de otro tipo de bacterias.
Como decía al principio, la microbiota de cada uno es única y depende mucho del entorno en el que viva. Se ha visto que los bebés que conviven estrechamente con hermanos tienen una proporción mayor de bifidobacterias, aunque también aumenta el conteo de E.coli (4) (ya sabemos que los niños lo tocan todo y no siempre se lavan las manos correctamente)
Aun hay mucho que investigar, todavía no estamos sino descubriendo el principio de algo que, en mi opinión, puede revolucionar el paradigma en obstetricia. Quizás, dentro de unos años, si promocionamos una microbiota saludable en madres y bebés, podamos promocionar globalmente la salud, no solo materno-infatil, sino poblacional a largo plazo.
La influencia del abuso de antibióticos, no solo por la creación de superbacterias resistentes a cada vez más antibióticos, sino por la destrucción de la microbiota sana, puede tener consecuencias devastadoras en la salud de las poblaciones. Quizás dentro de unos años, si cultivamos una microbiota sana, no necesitemos tantos antibióticos, o al menos nos lo pensemos un par de veces antes de prescribirlos como si fueran agua.
Aunque en algunos puntos no existe aún evidencia suficientemente fuerte, podemos empezar a pensar e intuir recomendaciones para, como comadronas, empezar los primeros pasos en el cambio de paradigma.
- Antes del embarazo y durante el embarazo
- Elimina el estrés de tu vida
- Consume productos de origen orgánico y dieta biodinámica. Por supuesto, nada de alcohol, tabaco y otras drogas.
- Evita usar antibióticos si no son estrictamente necesarios
- No uses productos de higiene antimicrobianos: agua y jabón es suficiente, la flora de tu piel está ahí para protegerte y en el futuro proteger a tu hijo/a
- Disfruta de la experiencia del embarazo
- Cultiva una flora vaginal sana.
- Evita de productos de higiene íntima con detergentes
- Evita tóxicos químicos en los productos menstruales
- Usa ropa interior de algodón
- Si tienes infecciones por hongos o vaginosis, apuesta por tratamiento probiótico (el yogur natural por ejemplo) en vez de antibióticos/antimicóticos. (13)
- Parto
- Atención al parto minimizando las intervenciones (incluidos tactos vaginales)
- Promoción del parto en casa
- Piel con piel no solo al nacimiento, sino durante las primeras semanas/meses de vida
- Si el bebé es prematuro, el contacto continuado piel con piel con madre/padre debería ser primordial.
- Antibióticos solo cuando sean estrictamente necesarios
- Tras su uso, probióticos para madre y bebé
- Contacto de los profesionales sanitarios con la vagina y periné materno y el bebé reducido a casos estrictamente necesarios.
- Si estás en el hospital, viste tu propia ropa, usa tus toallas e incluso lleva tus propias sábanas.
- No elimines el vérmix de la piel del bebé.
- Evita bañarle con jabón durante el primer mes de vida.
- Reduce las cesáreas innecesarias
- Si una cesárea es ne-cesárea:
- tomar una muestra de la flora vaginal (una gasa, una torunda) y pasarla por la boca del bebé y por su piel
- Eliminación de dosis rutinaria de antibiótico en todas las cesáreas.
- Primeros meses:
- Promoción de la lactancia materna exclusiva hasta los 6 meses y prolongada hasta mínimo los 2 años
- Inicio de la alimentación complementaria con alimentos orgánicos y biodinámicos (evitar alimentos preparados, ricos en azúcares).
- No impidas a los hermanos/as mayores que se relacionen y toquen al bebé
- Evita que personas fuera del entorno íntimo cojan al bebé.
- Evitar antibióticos innecesarios. De nuevo, tras un tratamiento con antibióticos, considerar probióticos.
Actualización Abril 2015:
Justo un día después de publicar esta entrada, se publicó una noticia sobre un estudio americano que describe como determinados genes en la madre, hacen que produzca ciertos azúcares en la leche específicos para alimentar determinado tipo de bacterias (bifidobacterias) y favorecer su colonización. Podéis consultar el artículo completo aquí.
Bibliografía
- Gervás J. El parto, mortalidad materna y encarnizamiento médico. 5 Oct 2014. Acta Sanitaria. Disponible aquí.
- Reed R and Johnson-Cash J. The Human Microbiome: considerations for pregnancy, birth and early mothering. 15 Jan 2015. Midwife thinking (blog). Disponible aquí.
- Young VB. The intestinal microbiota in health and disease. Curr Opin Gastroenterol. 2012; 28:63-9. Disponible aquí.
- Penders J et als. Factors influencing the composition of the intestinal microbiota in early infancy. Pediatrics. 2006 Aug. 118(2):511-21. Disponible aquí.
- Zijlmans et als. Maternal prenatal stress is associated with the infant intestinal microbiota. Psychoneuroendocrinology (2015) 53, 233-45. Disponible aquí.
- Wassenaar TM at als. Is a foetus developing in a sterile enviroment? Lett Appl Microbiol. 2014 Dec; 59(6):572-9. Disponible aquí.
- Aagaard K et als. The placenta harbors a unique microbiome. Sci Transl Med. 2014 May; 6(237):237-65. Disponible aquí.
- Jimenez E et als. Is meconium from healthy newborns actually sterile? Research in Microbiology. April 2008. 159(3); 187-193. Disponible aquí.
- Azad et als. Gut microbiota of healthy Canadian infants: profiles by mode of delivery and infant diet at 4 months. CMAJ. March 19, 2013. 185(5); 385-94. Disponible aquí.
- Tollin et als. Vernix caseosa as a multi-component defence system based on polypeptides, lipids and their interactions. Cell ol Life Sci. 2005 Oct; 62(19-20):2390-99. Disponible aquí.
- Collado MC et als. Microbial ecology and host-microbiota interactions during early life stages. Gut Microbes. 2012 Aug. 3:4, 352-65. Disponible aquí.
- Guaraldi et als. Effect of breast and formula feeding on gut microbiota shaping in newborns. Frontierns in Cellular and infection microbiology. Oct 2012; 2(94). Disponible aquí.
- Hantoushzadeh S et als. Comparative efficacy of probiotic yoghurt and clindamycin in treatment of bacterial vaginosis in pregnant women: a randomized clinical trial. The Journal of Maternal-Fetal & Neonatal Medicine. 2012 July. 25(7); 1021-4. Disponible aquí.